- 【硅的物理性质】
- 硅,元素符号Si,原子序数14,原子量28.086,位于第三周期第IVA族,共价半径117皮米,离子半径42皮米,第一电离能786.1kJ/mol,电负性1.8,密度2.33g/cm3,熔点1410℃,沸点2355℃,硬度7。元素硅有无定形硅和晶体硅两种同素异形体。无定形硅为黑色;晶体硅呈钢灰色,有明显的金属光泽、晶格和金刚石相同,硬而脆,能导电,但导电率不如金属且随温度的升高而增加,属半导体。在热处理温度大于750℃时,硅材料由脆性材料转变为塑性材料,在外加应力下,产生滑移位错,形成塑性变形。硅材料还具有一些特殊的物理性质,如硅材料熔化时体积缩小,固化时体积增大。
- 作为半导体材料,硅具有典型的半导体材料的电学性质。
- (1)阻率特性 硅材料的电阻率在10-5~1010Ω•cm之间,介于导体和绝缘体之间,高纯未掺杂的无缺陷的晶体硅材料称为本征半导体,电阻率在10Ω•cm以上。
- (2)PN结特性 N型硅材料和P型硅材料相连,组成PN结,这是所有硅半导体器件的基本结构,也是太阳电池的基本结构,具有单向导电性等性质。
- (3)光电特性 与其他半导体材料一样,硅材料组成的PN结在光作用下能产生电流,如太阳电池。但是硅材料是间接带隙材料,效率较低,如何提高硅材料的发电效率正是目前人们所追求的目标。
- 同位素
- 硅(原子质量单位: 28.0855)共有23种同位素,其中有3种天然的稳定同位素Si(92.2%)、Si(4.7%)和Si(3.1%),还有质量数为25、26、27、31和32的人工放射性同位素。
【硅的化学性质】

- 低温时单质硅不活泼,不与空气、水和酸反应。室温下表面被氧化形成1000皮米二氧化硅保护膜。高温时能跟所有卤素反应,生成四卤化硅,跟氧气在700℃以上时燃烧生成二氧化硅。跟氯化氢气在500℃时反应,生成三氯氢硅SiHCl3和氢气。高温下能跟某些金属(镁、钙、铁、铂等)反应,生成硅化物。赤热时跟水蒸气反应生成二氧化硅和氢气。跟强碱溶液反应生成硅酸盐放出氢气。跟氢氟酸反应生成四氟化硅。
【硅的分类】

- 按纯度可分为:工业硅、太阳能级硅、电子级硅。
- 按掺杂类型分为:本征硅、P型硅、N型硅。
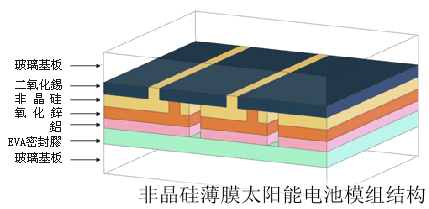
- 按晶体类型分为:单晶硅、多晶硅、非晶硅。
【晶态硅与非晶态硅的结构】
- 硅按照晶体形态分为晶态和非晶态两种,晶态硅又分为单晶硅和多晶硅,不同形态的硅材料具备不同的结构。
- (1)单晶硅的结构

- 单晶硅即硅的单晶体,具有基本完整的点阵结构晶体,不同的方向具有不同的性质,是一种良好的半导体材料。用于制造半导体器件,太阳能电池等。是采用高纯度的多晶硅在单晶炉内拉制而成的。熔融的单晶硅在凝固时硅原子以金刚石晶格排列成许多晶核,如果这些晶核长成晶面取向相同的晶粒,则这些晶粒平行结合起来便结晶成单晶硅。
- 单晶硅具有准金属的物理性质,有较弱的导电性,其电导率随温度的升高而增加,有显著的半导电性。单晶硅具有金刚石晶格,晶体硬而脆,具有金属光泽,但导电率不及金属,随着温度增加,具有半导体性质。如图7-6所示
- (2)多晶硅的结构

- 多晶硅,是单质硅的一种形态。熔融的单质硅在过冷条件下凝固时,硅原子以金刚石 晶格形态排列成许多晶核,如这些晶核长成晶面取向不同的晶粒,则这些晶粒结合起来,就结晶成多晶硅。
- 多晶硅具有灰色金属光泽,熔点1410℃。沸点2355℃。溶于氢氟酸和硝酸的混酸中,不溶于水、硝酸和盐酸。硬度介于锗和石英之间,室温下质脆,切割时易碎裂。加热至800℃以上即有延性,1300℃时显出明显变形。常温下不活泼,高温下与氧、氮、硫等反应。在高温熔融状态下,具有较大的化学活泼性,能与几乎任何材料作用。具有半导体性质,是极为重要的优良半导体材料,但微量的杂质即可大大影响其导电性。
- (3)非晶硅的结构
- 非晶硅又称无定形硅。单质硅的一种形态。棕黑色或灰黑色的微晶体,不具有完整的金刚石晶胞,纯度不高。熔点、密度和硬度也明显低于晶体硅。
- 非晶硅的用途很多,可以制成非晶硅场效应晶体管;用于液晶显示器件、集成式a—Si倒相器、集成式图象传感器、以及双稳态多谐振荡器等器件中作为非线性器件;利用非晶硅膜可以制成各种光敏、位敏、力敏、热敏等传感器;利用非晶硅膜制做静电复印感光膜,不仅复印速率会大大提高,而且图象清晰,使用寿命长;等等。目前非晶硅的应用正在日新月异地发展着,可以相信,在不久的将来,还会有更多的新器件产生。